En los últimos meses, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) que dirige Julio Sánchez y Tépoz realizó una serie de y anuncios pero, ¿qué es lo relevante? y ¿qué beneficios tiene para la industria farmacéutica?
Línea del tiempo
- 5 de julio de 2016: La Cofepris recibió el reconocimiento de entrada al Programa de Cooperación de Inspección Farmacéutica (PIC/S por sus siglas en inglés).
- 26 y 27 de junio de 2016: La Cofepris participa en la reunión de la Coalición Internacional de Titulares de Agencias Reguladoras de Medicamentos (ICMRA, por sus siglas en inglés) y anunció la adhesión formal de México como país observador del Consejo Internacional para la Armonización de los Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH).
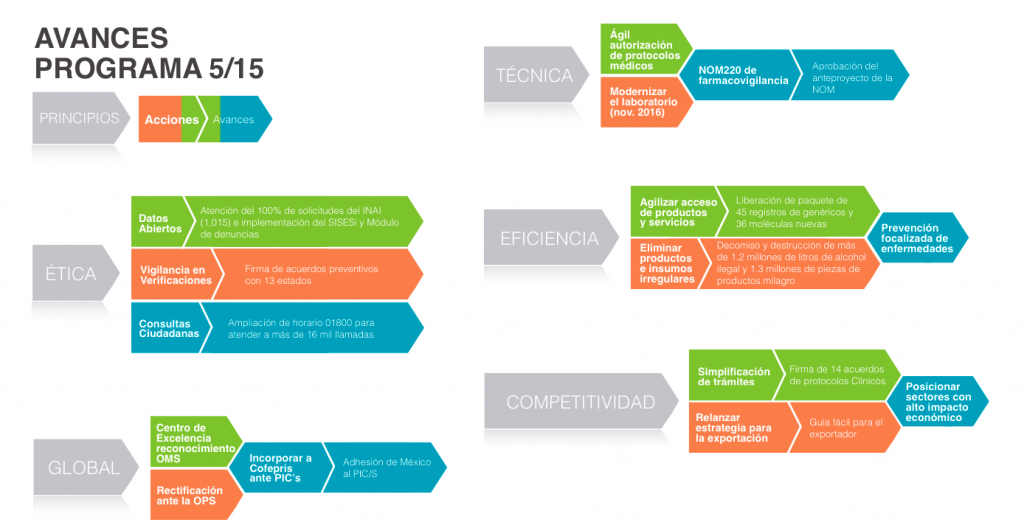
- 17 de marzo de 2016: La Cofepris revela el Programa 5/ 15
- 5 de febrero de 2016: La Secretaría de Salud (SSA) alineó con las mejores prácticas internacionales las Normas Oficiales Mexicanas 164 y 059, que entrarán en vigor el 2 y 3 de agosto respectivamente.
- 18 de diciembre de 2014: La Cofepris aplicó para ingresar al PIC/S.
Beneficios
- Los laboratorios podrán ahorrar 7 por ciento del valor de las exportaciones al no requerir que cada una de las 48 autoridades revise sus plantas, según cálculos oficiales.
- El principal objetivo del programa es consolidar una Comisión ética, técnica, eficiente, competitiva y global para procurar la protección contra riesgos sanitarios de los mexicanos.
- Fortalecer la investigación clínica en México a través de la autorización más ágil de protocolos clínicos, con el apoyo de los Institutos Nacionales
- La incorporación al PIC’s permitirá favorecer el intercambio de información entre países para impulsar mejores prácticas en materia sanitaria y de regulación.
- Ser parte de las mejores prácticas internacionales en beneficio de la salud pública y la competitividad del sector farmacéutico.
Un poco de historia
ICH
El Consejo Internacional para la Armonización de los Requisitos Técnicos para Productos Farmacéuticos de Uso Humano (ICH) se creó en 1990 para analizar aspectos científicos y técnicos de registro de medicamentos y reúne a las autoridades reguladoras y a la industria farmacéutica.
PIC/S
El Programa de Cooperación de Inspección Farmacéutica (Pharmaceutical Inspection Co-Operation Scheme, PIC/S por sus siglas en inglés) se creó en 1995 para construir estándares en el ámbito de las Buenas Prácticas de Manufactura (BPM) y lo integran 48 autoridades participantes procedentes de Europa, África, América y Asia.
ICMRA
La Coalición Internacional de Titulares de Agencias Reguladoras de Medicamentos (ICMRA, por sus siglas en inglés), se creó en 2006 con la finalidad establecer una coalición internacional de titulares de agencias reguladoras responsables de temas sanitarios y de medicamentos, para impulsar el desarrollo del sector.
